Programme
S1.1 Métabolisme et rôle de l’adénosine triphosphate (ATP)
Caractériser une chaîne de réactions biochimiques de synthèse ou de dégradation de molécules
0/2Principes généraux du métabolisme et rôle de l’adénosine triphosphate (ATP)
0/4Réactions de production ou d’utilisation d’ATP (glycolyse, cycle de Calvin, biosynthèse d’un acide aminé)
0/7Déduction du sens d’évolution spontanée d’une réaction chimique à partir de la valeur de l’enthalpie libre de réaction
0/2Intérêt du couplage chimio-chimique
0/2Couplage chimio-osmotique
0/3Calcul de la somme algébrique de valeurs d’enthalpie libre de réaction ΔrG pour des réactions couplées
0/4Mise en lien du concept d'enthalpie libre avec la thermodynamique en physique-chimie
0/2Comparaison de l’enthalpie libre standard de réaction et de l’enthalpie libre de réaction de l’hydrolyse d’ATP
0/2Hydrolyse de l'ATP
0/3Expliquer le rôle de l’ATP comme molécule énergétique intermédiaire du métabolisme dans la cellule
0/5ATP : cours général + exercices
0/2Écrire une demi-équation électronique d’oxydation ou de réduction
0/5Devoirs et Matériel pédagogique
0/4BONUS
0/2
Leçon
Fiche mémo : écrire une demi-équation électronique d’oxydation ou de réduction
Introduction
Une demi-équation électronique représente le transfert d’électrons lors d’une réaction redox, en isolant le processus d’oxydation ou de réduction. Elle est essentielle pour équilibrer et comprendre ces réactions.
Étapes pour écrire une demi-équation
1. Identifier le couple redox
- Repérer le couple (ex : Fe³⁺/Fe²⁺, MnO₄⁻/Mn²⁺).
2. Déterminer la variation d’oxydation
- Vérifier si l’élément s’oxyde ou se réduit en changeant son nombre d’oxydation.
3. Rédiger la demi-équation
- Réduction : ajouter des électrons pour équilibrer la baisse du nombre d’oxydation.
Exemple :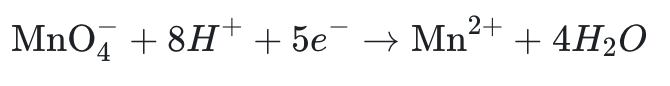
- Oxydation : retirer des électrons pour équilibrer la hausse du nombre d’oxydation.
Exemple :
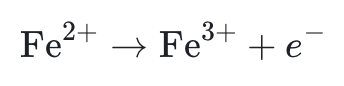
4. Équilibrer la demi-équation
- Assurer l’équilibre en atomes et en charges en ajoutant H⁺, H₂O ou électrons.
Exemple d’exercice
Écrire la demi-équation électronique de réduction du couple MnO₄⁻/Mn²⁺ en milieu acide.
Solution :
- Couple : MnO₄⁻/Mn²⁺ (Mn passe de +7 à +2).
- Réduction : MnO₄⁻ gagne des électrons pour devenir Mn²⁺.
- Demi-équation :
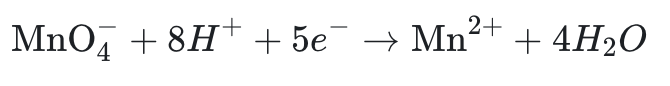
Résumé
- La demi-équation montre le transfert d’électrons.
- Elle est écrite en isolant le processus d’oxydation ou de réduction.
- Elle doit être équilibrée en atomes et en charges.
N’hésitez pas à pratiquer avec d’autres couples pour maîtriser cette technique essentielle en chimie.